Dúil cheimiceach
Is éard atá i ndúil cheimiceach ná substaint a bhfuil a cuid adamh go léir mar an gcéanna ó thaobh líon na bprótón de ina núicléis adamhacha. Murab ionann agus comhdhúile ceimiceacha, ní féidir dúile ceimiceacha a mhiondealú ina substaintí níos simplí trí mhodhanna ceimiceacha. Tá sainmhíniú na dúile ceimicí bunaithe ar líon na bprótón sa núicléas, agus deirtear gurb í a huimhir adamhach í (is í an litir Z an tsiombail a sheasann don uimhir adamhach)- Is adaimh den dúil chéanna iad na hadaimh go léir a bhfuil an uimhir adamhach chéanna acu. Tá damhnaí barónacha na cruinne go léir comhdhéanta as dúile ceimiceacha, a chuimsíonn adaimh de chineál ar bith, agus a sholáthraíonn an mhais dóibh. Ní fhaightear ach cuid bheag de na dúile, cosúil leis an airgead agus an t-ór, mar ghlandúile ar mianraí nádúrtha iontu féin iad. An chuid is mó de na dúile atá ar fáil sa dúlra, is mar chomhdhúile nó mar mheascán a fhaightear iad. Is éard atá san aer ná meascán den nítrigin, an ocsaigin agus dúile eile ar gás iad, argón thar aon cheann eile, cé go bhfuil comhdhúile ann chomh maith, an dé-ocsaíd charbóin agus an t-uisce ach go háirithe.
Thosaigh stair fionnachtana agus úsáide na ndúl roimh scríobh na staire. Bhí aithne ag muintir na sochaithe primitíbheacha féin ar an gcarbón, an sulfar, an copar agus an t-ór, cé nár thuig siad coincheap na ndúl go fóill. Na hiarrachtaí a rinneadh leis na hábhair seo a aicmiú, chuir siad bun le coincheap na ndúl clasaiceach, leis an ailceimic agus le teoiricí éagsúla eile i rith stair an duine.
Ba é an saineolaí Dmítrí Meindeiléiv ón Rúis a chuir tús leis an Tábla Peiriadach sa bhliain 1869, agus é tar éis a thabhairt faoi deara go raibh saintréithe na ndúl ag athrú ar bhealach thráthrialta, a chuir ar a chumas iad a ghrúpáil i roinnt colún (grúpaí) agus sraitheanna (peiriaid), de réir a meáchain adamhaigh, agus é ag tabhairt faoi deara an dóigh a raibh na hairíonna céanna ceimiceacha ag athfhilleadh taobh istigh de gach grúpa. Le linn na tréimhse sin, nuair a bhí Meindeiléiv ag obair, ní raibh tuiscint ag na heolaithe ar choincheap an núicléis go fóill, agus mar sin, ós rud é go raibh na hairíonna agus ordú na ndúl ag teacht salach ar a chéile in áiteanna, ghlac Meindiléiv leis gurbh fhéidir nach raibh luachanna an mheáchain adamhaigh tomhaiste go cruinn go fóill. Idir an dá linn, tuigeadh do na heolaithe gurb é líon na bprótón is bunús leis an bpeiriadacht, agus cé go bhfuil ordú na ndúl de réir an mheáchain adamhaigh sách gar don aicmiú de réir líon na bprótón sa núicléas, níl sé riachtanach gurbh ionann an dá ordú.
Faoi mhí na Samhna 2016, bhí 118 ndúil san iomlán aitheanta ag Aontas Idirnáisiúnta na Glan-Cheimice agus na Ceimice Feidhmí, eagraíocht idirnáisiúnta na gceimiceoirí. Tá an chéad 94 cinn acu ar fáil go nádúrtha ar an Domhan, agus is dúile sintéiseacha iad na 24 eile a tháirgtear in imoibrithe núicléacha. Ach amháin, i gcás dúile radaighníomhacha éagobhsaí (radanúiclídí) a dtagann meath orthu go gasta, tá beagnach gach ceann de na dúile ar fáil go tionsclaíoch. Réimse leanúnach staidéir eolaíoch is ea dúile nua breise a fhionnadh agus a shintéisiú.
Cur síos
cuir in eagarIs iad na dúile ceimiceacha is éadroime ná an hidrigin agus an héiliam. Cruthaíodh iad i núicléisintéis na hollphléisce le linn na chéad 20 nóiméad i gcroineolaíocht na cruinne i gcóimheas 3:1, a bheag nó a mhór, de réir maise (nó 12:1 de réir líon na n-adamh), mar aon le rianta beaga bídeacha den chéad dá dhúil eile, mar atá, an litiam agus an beirilliam. Rinneadh beagnach gach dúil eile a fuarthas sa nádúr trí mhodhanna nádúrtha éagsúla núicléisintséise. Ar an Domhan, gintear traidhfilín adamh nua go nádúrtha in imoibrithe núicléigineacha, nó i bpróisis chosmaigineacha, mar scealpadh gathanna cosmacha. Thairis sin gintear adaimh de chineál nua go nádúrtha ar an Domhan mar iníon-núiclídí (iníoniseatóip) nuair a thagann meath radaighníomhach ar radanúiclídí.
As na 94 dúil atá ar fáil sa dúlra tá aon iseatóp cobhsaí amháin ar a laghad acu siúd arb é a n-uimhir adamhach 82 nó níos ísle, amach ó dhúil a 43, mar atá, teicnéitiam, agus dúil a 61, mar atá, próiméitiam, nach bhfuil ach iseatóip radaighníomhacha acu. Iseatóip chobhsaí iad siúd nár aithníodh meath radaighníomhach ar bith orthu riamh. Maidir leis na dúile ó Z = 83 (an biosmat) go Z = 94 (an plútóiniam), tá iseatóp ag dúil as gach beart acu, a bheag nó a mhór, atá chomh fadsaolach is gur féidir glacadh leis gur toradh don núicléisintéis réaltach ollnóva é a ghin na miotail throma roimh fhoirmiú ár nGrianchórais. Is í an leathré atá ag biosmat a 209 an leathré is faide atá ag aon núiclíd a dtagann alfa-mheath uirthi, mar atá, 1.9 x 10[sup]19[/sup] bliain. Tá an leathré sin níos mó ná billiún oiread chomh fada ná aois na hollchruinne de réir mar a mheastar, agus mar sin bhí na heolaithe ag ceapadh ar feadh i bhfad gur dúil chobhsaí a bhí sa bhiosmat. Maidir leis na dúile atá níos troime ná an plútóiniam, tagann meath radaighníomhach orthu chomh tapa, agus leathré chomh gearr acu, is nach bhfuil siad ar fáil sa dúlra: mar sin ní mór iad a shintéisiú le heiseamail a fháil.
Uimhir Adamhach
cuir in eagarIs ionann uimhir adamhach na dúile agus líon na bprótón i ngach adamh, agus sainmhíníonn sí an dúil.[1] Mar shampla, tá 6 phrótón i núicléas gach adamh carbóin; mar sin is í uimhir adamhach an charbóin ná 6.[2] Scéal eile áfach líon na neodrón: is féidir nach ionann líon na neodrón i ngach núicléas, agus tugtar iseatóip ar na cineálacha éagsúla adaimh nach ionann líon na neodrón iontu cé gurb ionann líon na bprótón, ionas nach ionann maisuimhir na n-adamh sin ach an oiread.[3] Socraíonn líon na bprótón sa núicléas a lucht leictreach freisin, agus is ionann líon na leictreon agus na bprótón i ngach adamh nach bhfuil ianaithe, is é sin nach bhfuair leictreoin ar iasacht ó adamh eile agus nár thug leictreoin ar iasacht d'aon adamh eile ach an oiread. Tá na leictreoin ordaithe ar fhithiseáin adamhacha ar a bhfuil airíonna ceimiceacha éagsúla an adaimh bunaithe. De ghnáth, is beag éifeacht a bhíonn ag líon na neodrón sa núicléas ar airíonna ceimiceacha na dúile (ach amháin i gcás na hidrigine agus an deoitéiriam). Dá bhrí sin, tá airíonna ceimiceacha beagnach mar an gcéanna ag gach iseatóp carbóin toisc go bhfuil 6 phrótón agus 6 leictreon acu, cé go bhféadfadh 6 nó 8 neodrón a bheith ag adamh carbóin, mar shampla. Sin é an fáth go meastar gurb í an uimhir adamhach, seachas an mhaisuimhir nó an meáchan adamhach, an tréith aitheantais atá ag an dúil cheimiceach.
Is ionann uimhir adamhach na dúile, Z, agus líon na bprótón i núicléas an adaimh sin. Tabhair faoi deara go bhfuil leictreon de dhíth le lucht deimhneach leictreach an phrótóin a chealú. Mar sin, is ionann líon na bprótón sa núicléas agus líon na leictreon i néal leictreon an adaimh, agus is ar líon na leictreon a aithnítear saintréithe ceimiceacha an adaimh. Mar shampla, tá 8 bprótón i núicleas gach adamh ocsaigine; mar sin i gcás na hocsaigine, is ionann Z agus 8. Is féidir le hadaimh na dúile céanna líon éagsúil neodrón a bheith sa núicléas acu. Tugtar iseatóip ar na leaganacha den dúil chéanna nach ionann líon na neodrón acu.
Iseatóip
cuir in eagarIs adaimh iad na hiseatóip den dúil chéanna (is é sin, leis an líon céanna prótón ina núicléas adamhach), ach a bhfuil líon difriúil neodrón acu. Mar sin, mar shampla, tá trí phríomh-iseatóp carbóin ann. Tá 6 phrótón ag gach adamh carbóin sa núicléas, ach d’fhéadfadh 6, 7 nó 8 neodrón a bheith acu. Ós rud é gurb é 12, 13 agus 14 na huimhreacha maise díobh seo faoi seach, tugtar carbón-12, carbón-13, agus carbón-14 ar na trí iseatóp carbóin, go minic giorraithe go 12C, 13C, agus 14C. Is meascán é an carbón nádúrtha de 12C (thart ar 98.9%),13C (thart ar 1.1%) agus thart ar 1 adamh in aghaidh an trilliún de 14C.
Tá níos mó ná iseatóp cobhsaí amháin ag an gcuid is mó (66 de 94) de na dúile a tharlaíonn go nádúrtha. Seachas na hiseatóip hidrigine (atá difriúil go mór óna chéile i mais choibhneasta - go leor chun éifeachtaí ceimiceacha a dhéanamh), tá iseatóip dúile ar leith beagnach doscartha go ceimiceach.
Bíonn roinnt iseatóp ag na dúile go léir atá radaighníomhach (raidiseatóip), cé nach dtarlaíonn gach ceann de na raidiseatóip seo go nádúrtha. Is iondúil go meathann na raidiseatóip ina dúile eile nuair a radaíonn a halfacháithnín nó béite-cháithnín. Tarlaíonn gach ceann de na hiseatóip chobhsaí go nádúrtha (féach iseatóp príomhordúil). Tá an iliomad raidiseatóp nach bhfuil le fáil sa nádúr ina chomhartha sóirt tar éis iad a dhéanamh go saorga. Níl aon iseatóip chobhsaí ag dúile áirithe agus níl iontu ach iseatóip radaighníomhacha: go sonrach is iad na dúile gan aon iseatóip chobhsaí ná teicnéitiam (uimhir adamhach 43), próiméitiam (uimhir adamhach 61), agus gach dúil bhreathnaithe le huimhreacha adamhacha níos mó ná 82.
As na 80 dúil a bhfuil iseatóp cobhsaí amháin ar a laghad acu, níl ach iseatóp cobhsaí amháin ag 26 acu. Is í mheánuimhir na n-iseatóp cobhsaí do na 80 eilimint chobhsaí ná 3.1 iseatóp cobhsaí in aghaidh na dúile. Is é 10 an líon is mó iseatóip chobhsaí a tharlaíonn le haghaidh eilimint amháin (i gcás stáin, eilimint 50).
Mais iseatópach agus mais adamhach
cuir in eagarIs í an mhaisuimhir (siombail A, ón bhfocal Gearmánach Atomgewicht [meáchan adamhach]), [1] ar a dtugtar an mhaisuimhir adamhach nó an núicléónuimhir, suim líon na bprótón is na neodrón sa núicléas adamhach. Déantar idirdhealú idir iseatóip dhifriúla i ndúil ar leith de réir a maisuimhreacha, a scríobhtar de ghnáth mar fhorscríbhinn ar thaobh na láimhe clé den tsiombail adamhach (e.g.238U). Is slánuimhir í an mhaisuimhir i gcónaí agus tá an t-aonaid “núicléón” aici. Mar shampla, is adamh é maignéisiam-24 (24 an mhaisuimhir) le 24 núicléón (12 prótón agus 12 neodrón).
Cé nach ndéanann an mhaisuimhir ach líon iomlán na neodrón agus na bprótón a chomhaireamh agus dá bhrí sin is uimhir aiceanta (nó iomlán) í, is réaduimhir í mais adamhach an adaimh aonair a thugann mais iseatóip áirithe (nó "núiclide") na dúile, leagtha síos mar aonad maise adamhaí (siombail: u). Go ginearálta, tá difríocht idir luach na maisuimhreach i núiclide ar leith óna mais adamhach, ós rud é nach ionann mais gach prótón agus neodrón agus 1 u; ós rud é go gcuireann na leictreoin sciar níos lú leis an mais adamhach de réir mar a sháraíonn uimhir an neodróin uimhir an phrótóin; agus (faoi dheireadh) mar gheall ar an bhfuinneamh nascach núicléach. Mar shampla, is í mais adamhach clóirín-35 go cúig dhigit shuntasacha ná 34.969 u agus is í mais clóirín-37 36.966 u. Mar sin féin, tá an mhais adamhach in u de gach iseatóp gar go leor dá mhais shimplí (laistigh de 1% i gcónaí). Is é 12C an t-aon iseatóp a bhfuil a mais adamhach díreach mar slánuimhir, a bhfuil mais de 12 aici de réir sainmhínithe toisc go sainmhínítear u mar 1/12 de mhais d'adamh neodrach saor carbóin-12 sa bhunstaid .
Is é an meáchan adamhach caighdeánach (ar a dtugtar "meáchan adamhach" de ghnáth) dúile ná meán na maiseanna adamhacha iseatóip uile na dúile ceimicí mar a fhaightear i dtimpeallacht ar leith í, ualaithe ag raidhse iseatópach, i gcoibhneas leis an aonad maise adamhaí. Féadfaidh an uimhir seo a bheith ina codán nach bhfuil gar do shlánuimhir. Mar shampla, is í an mhais adamhach choibhneasta clóirín ná 35.453 u, atá difriúil go mór ó slánuimhir toisc gur meán de thart ar 76% clóirín-35 agus 24% clóirín-37 í. Aon uair a bhíonn luach na maise adamhaí difriúil níos mó ná 1% ó slánuimhir, is mar gheall ar an éifeacht meánaithe seo atá sé, toisc go bhfuil méideanna suntasacha níos mó ná iseatóp amháin i láthair go nádúrtha i sampla den eilimint sin.
Íon go ceimiceach agus go hiseatópach
cuir in eagarTá sainmhínithe difriúla ag ceimiceoirí agus eolaithe núicléacha ar cad is dúil íon ann. Sa cheimic, is é is brí le dúil íon ná dúil a bhfuil an uimhir adamhach chéanna i ngach adamh aici (nó beagnach gach ceann acu i ndáiríre), nó a bhfuil an líon prótón céanna aici, Sainmhíníonn eolaithe núicléacha, áfach, dúil íon mar cheann nach bhfuil inti ach iseatóp cobhsaí amháin.[4]
Mar shampla, tá sreang chopair 99.99% íon go ceimiceach más copar é 99.99% dá cuid adamh, is é sin 29 bprótón i ngach ceann acu. Níl sé íon go hiseatópach, áfach, mar tá dhá iseatóp chobhsaí sa ghnáthchopar, 69% 63Cu agus 31% 65Cu, le líon difriúil neodrón. Mar sin féin, bheadh uinge óir íon go ceimiceach agus go hiseatópach araon, ós rud é nach bhfuil sa ghnáthór ach aon iseatóp amháin,197Au.
Allatróip
cuir in eagarFéadfaidh adaimh na ndúl ceimiceach nascadh lena chéile go ceimiceach ar níos mó ná bealach amháin, rud a ligeann don dúil íon a bheith ann i struchtúir ceimiceacha iolracha (na dúil leagtha amach go spásúil), ar a dtugtar allotróip, atá difriúil ina n-airíonna. Mar shampla, is féidir carbón a fháil mar dhiamant, a bhfuil struchtúr teitrihéidreach timpeall ar gach adamh carbóin; graifít, a bhfuil sraitheanna d’adamh carbóin ann le struchtúr heicseagánach carntha ar bharr a chéile; graiféin, atá ina shraith amháin de ghraifít atá an-láidir; fullairéiní, a bhfuil cruthanna beagnach sféarúla acu; agus nainfheadán carbóin, ar feadáin iad le struchtúr heicseagánach (fiú amháin d’fhéadfadh siad seo a bheith difriúil óna chéile in airíonna leictreacha). Tugtar 'allatrópacht' ar chumas na dúile a bheith ann i gceann amháin de go leor foirmeacha struchtúracha.
Sainmhínítear an staid chaighdeánach, ar a dtugtar an staid thagartha freisin, mar a staid is cobhsaí go teirmidinimiciúil ag brú 1 bar agus ag teocht ar leith (ag 298.15 K de ghnáth). Sa teirmiceimic, sainmhínítear dúil le heantalpacht chruthaithe de nialas ina staid chaighdeánach. Mar shampla, is graifít an staid thagartha do charbón, toisc go bhfuil struchtúr na graifíte níos cobhsaí ná struchtúr na n-allotróp eile.
Airíonna
cuir in eagarIs féidir airíonna na ndúl a rangú a bheag nó a mhór ar na ndúile, lena n-áirítear machnamh ar a n-airíonna fisiceacha ginearálta agus ceimiceacha ginearálta, a staid damhna faoi ghnáthdhálaí, a leáphointe agus fiuchphointe, a ndlúis, a struchtúir criostail mar sholaid, agus a mbunús.
Airíonna ginearálta
cuir in eagarÚsáidtear roinnt téarmaí go coitianta chun airíonna fisiceacha agus ceimiceacha ginearálta na ndúl ceimiceach a shainaithint. Déantar an chéad idirdhealú idir miotail, a sheolann leictreachas go héasca, neamh-mhiotail, nach seolann leictreachas, agus grúpa beag, (na miotalóidigh), a bhfuil airíonna idirmheánacha acu agus a bhíonn ag gníomhú go minic mar leathsheoltóirí.
Is minic a thaispeántar aicmiú níos beaichte i gcur i láthair daite den tábla peiriadach. Cuireann an córas seo srian ar na téarmaí "miotal" agus "neamhmhiotal" go dtí cuid áirithe de na miotail agus na neamh-mhiotail níos sainmhínithe, ag cur téarmaí breise le haghaidh tacair áirithe de na miotail agus na neamh-mhiotail a fheictear de ghnáth. Cuimsíonn an leagan den aicmiú seo a úsáidtear sna táblaí peiriadacha a chuirtear i láthair anseo: achtainídí, miotail alcaileacha, Miotal cré-alcaileach, halaiginí, lantanóidigh, miotail trasdultacha, miotail bhochta, miotalóidigh, neamh-mhiotail imoibríocha, agus triathgháis. Sa chóras seo, is grúpaí speisialta de na miotail a bhreathnaítear ar chiall níos leithne iad na miotail alcaileacha, miotail chré-alcaileacha, agus miotail trasdultacha, chomh maith leis na lantanóidigh agus na achtanóidigh. Ar an gcaoi chéanna, is neamh-mhiotail iad na neamh-mhiotail imoibríocha agus na triathgháis sa chiall is leithne. I roinnt cur i láthair, ní dhéantar idirdhealú idir na halaiginí, agus sainaithnítear astaitín mar mhiotóideach agus aithnítear na cinn eile mar neamh-mhiotail.
Staideanna damhna
cuir in eagarIdirdhealú bunúsach eile a úsáidtear go coitianta i measc na n-eilimintí is ea a staid dhamhna (céim), cibé acu sholadach, leachtach nó ghásach, ag teocht agus brú caighdeánach roghnaithe (TBC). Is solaid iad an chuid is mó de na dúile ag gnáth-theochtaí agus brú atmaisféarach, agus gáis iad roinnt acu. Níl ach bróimín agus mearcair ina leachtanna ag 0 céim Celsius agus gnáthbhrú atmaisféarach; is solaid iad caeisiam agus gailliam ag an teocht sin, ach leáíonn siad ag 28.4 °C
Leáphointe agus fiuchphointe
cuir in eagarÚsáidtear leáphointí agus fiuchphointi, a chuirtear in iúl de ghnáth i gcéimeanna Celsius ag brú d'atmaisféar amháin, chun na ndúl éagsúil a thréithriú. Cé go bhfuil sé ar eolas i gcás fhormhór na ndúl, tá ceachtar de na tomhais seo nó an dá thomhas fós neamhchinntithe maidir le cuid de na dúile radaighníomhacha nach bhfuil ar fáil ach i gcainníochtaí beaga bídeacha. Ós rud é go bhfanann héiliam ina leacht fiú ag dearbhnialas ag brú an atmaisféir, níl aige aige ach fiuchphointe, agus ní leáphointe, i gcur i láthair traidisiúnta.
Dlús
cuir in eagarÚsáidtear an dlús ag teocht agus brú caighdeánach roghnaithe (BCR) go minic chun na ndúl a thréithriú. Is minic a chuirtear dlús in iúl i ngraim in aghaidh an cheintiméadair chiúbaigh (g/cm3). Ós rud é gur gáis iad roinnt dúl ag teochtaí a bhíonn coitianta, luaitear a ndlúis de ghnáth i bhfoirmeacha gásacha; nuair a bhíonn siad leachtaithe nó soladaithe, tá dlúis ag na dúile gásacha atá cosúil le na dúile eile.
Nuair a bhíonn allotróip ag dúil le dlúis éagsúla, roghnaítear allotróp ionadaíoch amháin i gcur i gcur i láthair achomair, agus is féidir dlúis do gach allotróp a lua nuair a chuirtear níos mó sonraí ar fáil. Mar shampla, tá dlúis 1.8–2.1, 2.267, agus 3.515g/cm3, faoi seach, ag na trí ghnáth allotrópis de charbón (carbón éagruthach, graifít agus diamant).
Criostalstruchtúir
cuir in eagarTá ocht gcineál criostalstruchtúr ag na dúile a ndearnadh staidéar orthu go dtí seo mar shamplaí soladacha: bunchiúbach, corp-lárnach, éadan leithleac-ciúbach, heicseagánach, aonchlaonasach, ortarombach, rombaihéidreach, agusteitreagánach. I gcás cuid de na heilimintí trasúránacha a tháirgtear go sintéiseach, ní raibh go leor samplaí ar fáil chun struchtúir criostail a chinneadh.
Tarlú agus bunús ar an Domhan
cuir in eagarFéadfar dúile ceimiceacha a chatagóiriú freisin de réir a mbunús ar an Domhan, agus meastar go dtarlaíonn an chéad 94 go nádúrtha, agus táirgeadh iad siúd a bhfuil uimhreacha adamhacha níos mó ná 94 acu go saorga mar tháirgí sintéiseacha imoibrithe núicléacha de dhéantús an duine
As na 94 dúile a tharlaíonn go nádúrtha, meastar go bhfuil 83 díobh príomhordúil agus seasmhach nó lagradaighníomhach. Tá leathréanna róghearr ag na 11 dúil eile a tharlaíonn go nádúrtha ionas go mbeadh siad in ann bheith i láthair ag tús an Ghrianchórais, agus dá bhrí sin meastar gur dúile neamhbhuana iad. As na 11 dúil neamhbhuan seo, is táirgí meatha measartha coitianta de tóiriam agus úráiniam cúigear acu (polóiniam, radón, raidiam, actiniam, agus protactinium). Is annamh a bhíonn na 6 dúil neamhbhuan eile (technetium, promethium, astatine, francium, neptunium, and plutonium) ann, mar tháirgí de mhodhanna meatha neamhchoitianta nó de phróisis imoibrithe núicléacha ina bhfuil úráiniam nó dúile troma eile.
Níor breathnaíodh meath radaighníomhach ar dúile le huimhreacha adamhacha 1 go 82, seachas 43 (technetium) agus 61 (promethium). Meastar, áfach, go mbeidh iseatóip de roinnt dúl atá chobhsaí ó thaobh breathnóireachta de (mar shampla tungstain agus luaidhe) beagáinín radaighníomhach le leathréanna an-fhada: mar shampla, tá na leathréanna tuartha do na hiseatóip luaidhe atá seasmhach ó thaobh breathnóireachta ó 1035 go 10189 bliain. Tá dúile le huimhreacha adamhacha 43, 61, agus 83 go dtí 94 éagobhsaí go leor gur féidir a gcuid radaighníomhacha a bhrath go héasca. Tá iseatóip amháin nó níos mó ag trí cinn de na dúile seo, biosmat (dúil 83), tóiriam (dúil 90), agus úráiniam (dúil 92) le leathréanna fada go leor le maireachtáil mar iarsmaí den núicléisintéis réaltach phléascach a tháirg na dúile troma roimh fhoirmiú an Ghrianchórais. Mar shampla, ag níos mó ná 1.9×1019 bliain, tá an leathré Alfa-mheath is faide ar eolas ag bismuth-209 d'aon dúil a tharlaíonn ó nádúr. Tagann na 24 dúil is troime faoi meath radaighníomhach (iad siúd seachas plútóiniam, dúil 94) le leathréanna gearra agus ní féidir iad a tháirgeadh mar iníonacha le dúile a mhaireann níos faide, agus ní fios go dtarlaíonn siad ó nádúr ar chor ar bith
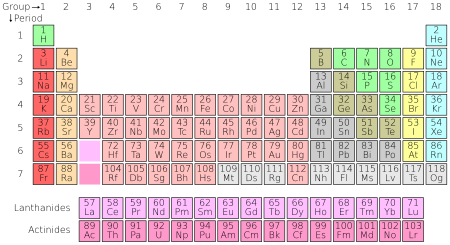
Tábla peiriadach
cuir in eagarCód datha
cuir in eagar| Grúpa → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Peiriad ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He |
||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
||
| 6 | 55 Cs |
56 Ba |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
||
| 7 | 87 Fr |
88 Ra |
* |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
|
| * Lantanóidigh | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|||||
| ** Achtainídí | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
|||||
Is minic a dhéantar achoimre ar airíonna na ndúl ceimiceach ag baint úsáide as an tábla peiriadach, a eagraíonn na dúile go cumhachtach agus go galánta, iad leagtha amach chun treochtaí ina n-airíonna fiseacha agus ceimiceacha a léiriú, ina sraitheanna ("peiriaid") ina roinneann na colúin ("grúpaí") airíonna athfhillteach ("peiriadach") fisiceach agus ceimiceach. Tá 118 eilimint dheimhnithe sa tábla caighdeánach reatha amhail 2019.
Fiú amháin roimh réamhtheachtaí an chur i láthair seo, tá sé curtha síos go ginearálta don cheimiceoir Rúiseach Dmitri Mendeleev gurb é a chruthaigh an tábla sa bhliain 1869, chun treochtaí athfhillteacha airíonna na ndúl a léiriú. Bhí leagan amach an tábla beachtaithe agus leathnaithe le himeacht ama, de réir mar a fionnadh dúile ceimiceacha, agus de réir mar a forbraíodh samhlacha teoiriciúla nua chun iompar ceimiceach a mhíniú..
Tá úsáid an tábla anois uileláithreach laistigh de dhisciplín acadúil na ceimice, ag soláthar creata thar a bheith úsáideach chun na cineálacha éagsúla iompraíochta ceimiceacha a aicmiú, a chóiriú agus a chur i gcomparáid. Tá feidhm leathan leis sa tábla freisin san fhisic, sa gheolaíocht, sa bhitheolaíocht, in eolaíocht na n-ábhar, innealtóireacht, talmhaíocht, leigheas, cothú, sláinte comhshaoil agus réalteolaíocht. Tá tábhacht ar leith ag baint lena phrionsabail san innealtóireacht cheimiceach.
Ainmníocht agus siombailí
cuir in eagarAithnítear na dúile ceimiceacha éagsúla go foirmiúil de réir a n-uimhreacha adamhacha uathúla, de réir a n-ainmneacha inghlactha, agus de réir a siombailí.
Uimhreacha adamhacha
cuir in eagarTá uimhreacha adamhacha ó 1 go 118 ag na dúile aitheanta, a chuirtear i láthair de ghnáth mar uimhreacha Arabacha. Ós rud é gur féidir na dúile a chur in ord uathúil de réir na huimhreach adamhaí, de ghnáth ón gceann is ísle go dtí an ceann is airde (mar atá i dtábla peiriadach), uaireanta sonraítear sraith dúl leis an nodaireacht a leithéid agus "trí", "thar", nó "ó ... trí" , mar "trí iarann", "thar úráiniam", nó "ó lantanam trí lúitéitiam". Úsáidtear na téarmaí "éadrom" agus "trom" go neamhfhoirmiúil uaireanta chun uimhreacha adamhacha coibhneasta (ní dlúis) a léiriú, mar atá i "níos éadroime ná carbón" nó "níos troime ná luaidhe", cé go teicniúil ní mhéadaíonn meáchan nó mais na n-adamh i ndúil (a gcuid meáchain adamhacha nó a maiseanna adamhacha) go haontonach i gcónaí lena n-uibhreacha adamhacha.
Ainmneacha na nDúl
cuir in eagarTagann ainmniú substaintí éagsúla ar a dtugtar dúile orthu anois roimh na teoirice admhaí, mar gur thug cultúir éagsúla ainmneacha áitiúla do mhianraí, mhiotail, chomhdhúile, chóimhiotail, mheascáin agus ábhair eile, cé nach raibh sé ar eolas ag an am cé na ceimiceáin ar dúile iad agus ar comhdhúile iad. De réir mar a aithníodh iad mar dúile, coinníodh na hainmneacha a bhí ann cheana do dhúile a raibh sean-eolas orthu (e.g. ór, mearcair, iarann) i bhformhór na dtíortha. Tháinig difríochtaí náisiúnta chun cinn maidir le hainmneacha na ndúl maidir le háisiúlacht, cáiréis teangan nó náisiúnachais. Chun an pointe a léiriú: úsáideann Gearmáinise "Wasserstoff" (substaint uisce) le haghaidh "hidrigin", "Sauerstoff" (substaint aigéadach) le haghaidh "ocsaigin" agus "Stickstoff" (substaint plúchta) le haghaidh "nítrigin", agus úsáideannan lucht an Bhéarla agus roinnt lucht na dteangacha rómánsacha "sóidiam" in ionad "natrium" agus "potaisiam" in ionad "kalium", agus is fearr leis na Francaigh, na hIodálaigh, na Gréagaigh, an Phortaingéalaigh agus na Polannaigh "azote / azot / azoto" (ó fhréamhacha a chiallaíonn "gan beatha") in ionad "nítrigin" .
Stair
cuir in eagarBaineadh an chéad úsáid as an téarma dúil (stoicheia) thart ar 360 RC. Ba é an fealsamh Gréagach Platón a luaigh é ina agallamh beirte Timaeus, ar tráchtas bunúsach é ar an gceimic agus ar an bpáirt atá aici i gcomhdhéanamh na neachanna beo agus na gcorpán neamhbheo. Shíl Plato go raibh cruth speisialta ar na cáithníní is lú a bhí i ngach dúil: teitrihéadrán (tine), ochtaihéadrán (aer), icisihéadrán (uisce), agus ciúb (cré).[5]
| Teitrihéadrán (tine) | Ochtaihéadrán (aer) | Icisihéadrán (uisce) | Ciúb (cré) |
Sa bhliain 1661, léirigh Robert Boyle go raibh níos mó dúile ann ná na ceithre cinn chlasaiceacha. Ba é Antoine Laurent Lavoisier a chuir an chéad liosta nua-aimseartha de na dúile le chéile sa bhliain 1789. Thug sé Dúile na Ceimice air, agus bhí trí dhúil déag is fiche ann. Ní raibh an liosta sin saor go fóill ó phiseog choitianta na seancheimiceoirí a d'áirigh an solas agus an teas mar dhúile, áfach. Sa bhliain 1828, chuir Jöns Jakob Berzelius tábla na ndúl le chéile a bhí bunaithe ar na meáchain adamhacha. Chuimsigh an liosta sin cúig cinn is dhá scór den naoi ndúil is dhá scór a raibh glacadh leo sa cheimic chomhaimseartha. Bhí sé dhúil is trí scór sa Tábla Peiriadach cáiliúil a d'fhoilsigh Meindeiléiv don chéad uair sa bhliain 1869 (léirithe thíos).
Ó ré Boyle, go dtí tús an 20ú chéad, ba é an sainmhíniú a bhí ar dhúil ná substaint cheimiceach íon nach féidir a bhriseadh síos go substaintí níos simplí.[6]. Lena chur i malairt focal, ní féidir "dúil" a chlaochlú go substaintí eile trí phróisis cheimiceacha. Tháinig athrú ar an tuiscint seo sa bhliain 1913 nuair a fuair Henry Moseley amach gurb é an lucht leictreach i núicléas an adaimh is bunús le huimhir adamhach an adaimh.
Bhí dhá dhúil déag is trí scór aimsithe sa bhliain 1919.[7]. Aimsíodh an 101ú dúil sa bhliain 1955 agus tugadh meindiléiviam uirthi in ómós do Mheindeiléiv. Sa bhliain 2006, tuairiscíodh gur éirigh leis na saineolaithe dúil uimhir a 118 a shintéisiú sa tsaotharlann, cé nach raibh dúil uimhir a 117 cruthaithe ag aon fhoireann taighde go fóill.
Mais Adamhach
cuir in eagarIs ionann maisuimhir na dúile (A) agus líon na núicléón (prótóin agus neodróin) sa núicléas adamhach. Ar na maisuimhreacha a aithnítear iseatóip na dúile céanna thar a chéile. De ghnáth, is mar fhorinnéacs ar thaobh na láimhe clé den tsiombail adamhach a scríobhtar an mhaisuimhir (m.sh., 238U).
Is ionann mais adamhach choibhneasta na dúile agus meánmhais na n-adamh sa dúil, cibé iseatóp iad. Úsáidtear an t-aonad maise adamhaí aontaithe (AMAA) leis an mais adamhach a thomhas.
Tagairtí
cuir in eagar- ↑ "Cóip cartlainne". Cartlannaíodh an bunleathanach ar 12 Feabhra 2014. Dáta rochtana: 8 Feabhra 2021.
- ↑ Tá ort na shonrú' 'teideal = agus' 'url = nuair a úsáideann {{ lua idirlín}}."".
- ↑ "Cóip cartlainne". Cartlannaíodh an bunleathanach ar 11 Eanáir 2014. Dáta rochtana: 8 Feabhra 2021.
- ↑ "Cóip cartlainne". Cartlannaíodh an bunleathanach ar 13 Meitheamh 2017. Dáta rochtana: 8 Feabhra 2021.
- ↑ "The Problem of the Soul in Aristotle's De anima" (2004). Cartlannaíodh an bunleathanach ar 2006-09-09. Dáta rochtana: 2007-05-10.
- ↑ Boyle, Robert (1661). "The Sceptical Chymist".
- ↑ Carey, George, W. (1914). "The Chemistry of Human Life".